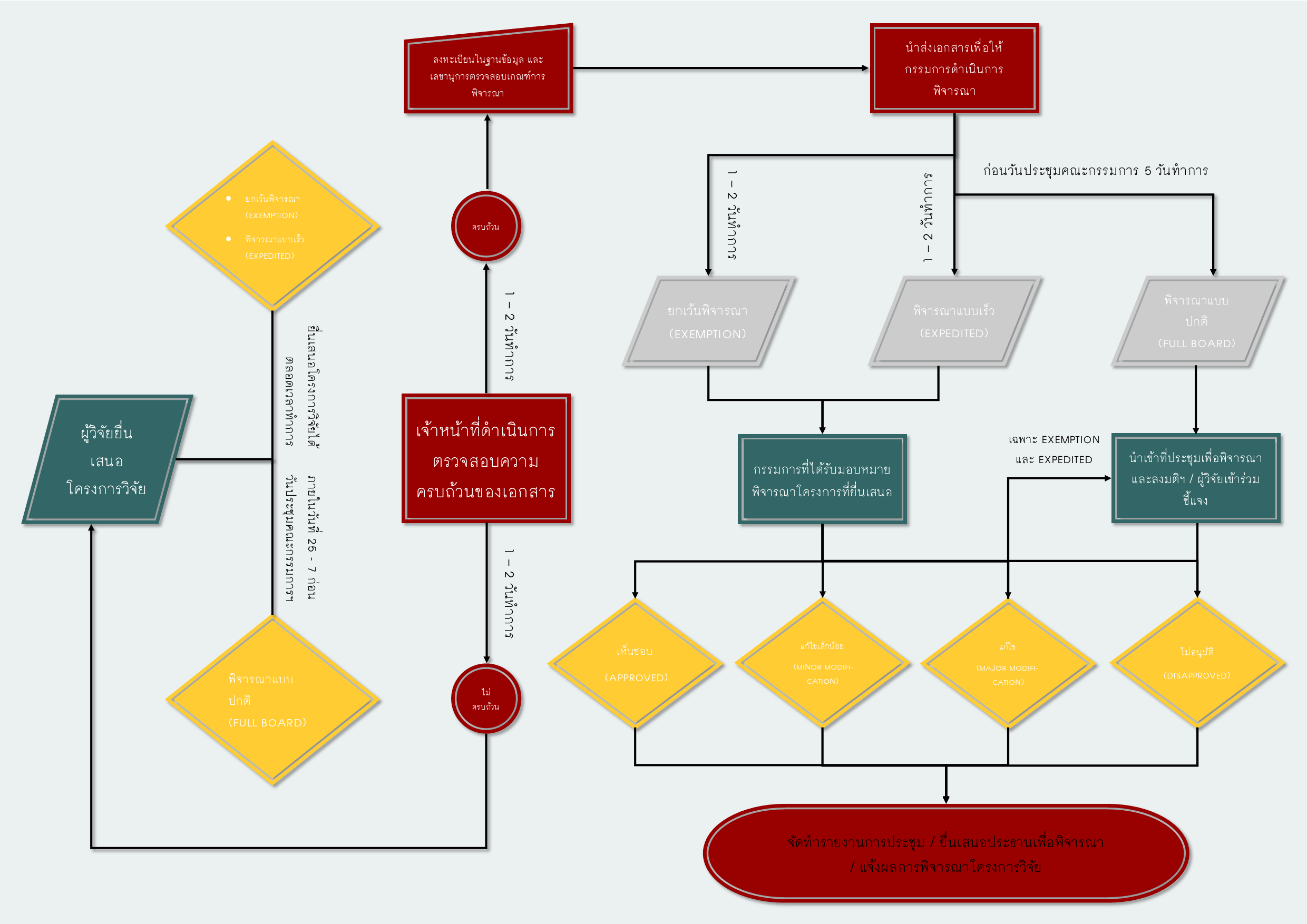
การยื่นขอรับจริยธรรมการวิจัยในมนุษย์ คือสิ่งแรกที่ผู้วิจัยพึงจะต้องปฏิบัติ เนื่องจากโครงการวิจัยใด ๆ ที่ต้องการเก็บข้อมูลหรือดำเนินการใด ๆ กับผู้ป่วยที่อยู่ภายใต้โรงพยาบาลเลิดสิน ต้องขอรับการรับรองจริยธรรมการวิจัยในมนุษย์เสียก่อน หากไม่มีการรับรองจะถือว่าการกระทำโครงการวิจัยนั้นเป็นการละเมิดสิทธิ์ต่อข้อมูลของผู้ป่วย และทางโรงพยาบาลเลิดสินจะไม่เห็นชอบให้ดำเนินการทำวิจัยหรือเก็บข้อมูล โดยการยื่นขอรับจริยธรรมการวิจัยในมนุษย์ครั้งแรก (Initial submission) นั้น ผู้วิจัยจะต้องตรวจสอบโครงการวิจัยที่ต้องการขอรับรองจริยธรรมว่าโครงการวิจัยของท่านเข้าเกณฑ์การพิจารณาใด โดยสามารถตรวจสอบได้ในเอกสาร "AF-.... การจำแนกเกณฑ์การพิจารณาทบทวน"
เกณฑ์การพิจารณาในการยื่นขอรับจริยธรรมการวิจัยในมนุษย์นั้นจะมีเกณฑ์การพิจารณาอยู่ทั้งหมด 3 ประเภท ได้แก่
การยกเว้นการพิจารณา (Exemption)
สำหรับโครงการวิจัยที่่สามารถขอยกเว้นการรับรองตามเกณฑ์ที่กำหนดไว้ตาม "AF-01-007/01.0 - การจำแนกเกณฑ์การพิจารณาทบทวน" โดยเจ้าหน้าที่ของสำนักงานฯ จะรับโครงร่างการวิจัยจากผู้วิจัย พร้อมทั้งตรวจสอบความครบถ้วนของโครงการวิจัย และเอกสารที่เกี่ยวข้อง ตามเอกสาร AF-02-007/01.0 กรรมการและเลขานุการฯ ตรวจสอบว่าโครงร่างการวิจัยมีลักษณะตามหลักเกณฑ์ ว่าเหมาะสมว่าจะได้รับยกเว้นการพิจารณาหรือไม่ และบันทึกผลการพิจารณาในเอกสาร AF-01-009/01.0
- งานวิจัยด้านการศึกษาโดยต้องเป็นโครงร่างการวิจัยที่ดำเนินการในสถาบันการศึกษาที่ได้รับการรับรองมาตรฐาน เกี่ยวข้องกับกระบวนการเรียนการสอนตามปกติและงานวิจัยยุทธศาสตร์ใหม่ทางการศึกษาตามนโยบายของสถาบัน
- งานวิจัยประยุกต์วิธีประเมินการศึกษาในด้าน Cognitive, Diagnostic, Aptitude, Achievement งานวิจัยสำรวจความคิดเห็นในวงกว้าง การสัมภาษณ์หรือเฝ้าสังเกตพฤติกรรม งานวิจัยจะได้รับ ยกเว้นพิจารณาเมื่อ
- การเก็บข้อมูลและข้อมูลที่ได้ไม่เกี่ยวข้องหรือบ่งชี้ถึงตัวบุคคล
- ขั้นตอนการวิจัยและผลที่ได้ไม่เป็นเหตุให้อาสาสมัคร หรือบุคคลใดต้องรับโทษทั้งอาญาและแพ่ง หรือทำให้เสียโอกาสในอาชีพหน้าที่การงาน
- ถ้างานวิจัยดังกล่าวดำเนินการเฉพาะกับกลุ่มบุคคลสาธารณะ หรือกลุ่มบุคคลที่กำลังจะได้รับการคัดเลือกเข้าสู่ตำแหน่งงานที่เกี่ยวข้องกับสาธารณะ
- งานวิจัยนั้นไม่สามารถรับการยกเว้นงานวิจัยซึ่งนำผลตรวจที่มีอยู่แล้วมาทำการวิเคราะห์ใหม่ในภาพรวมโดยไม่เชื่อมโยงถึงข้อมูลส่วนบุคคล เช่น วิเคราะห์ผลการตรวจชิ้นเนื้อไตทางพยาธิวิทยา 10 ปีย้อนหลัง เป็นต้น
- งานวิจัยเกี่ยวกับเชื้อจุลชีพโดยใช้เชื้อที่เพาะเลี้ยงไว้ในห้องปฏิบัติการ หรืองานวิจัยที่ใช้ตัวอย่างจุลชีพที่แยกได้จากสิ่งส่งตรวจโดยไม่เชื่อมโยงกับข้อมูลส่วนบุคคล
- งานวิจัยซึ่งทำการศึกษาใน Commercially available cell lines or Commercial biomaterial และดำเนินการวิจัยในห้องปฏิบัติการ
- งานวิจัยเกี่ยวกับรสชาติ คุณภาพของอาหารและความพึงพอใจของผู้บริโภคในภาพรวม โดยอาหารที่นำมาทดสอบต้องปลอดภัยและได้มาตรฐานตามข้อกำหนดของสำนักงานคณะกรรมการอาหารและยา
- งานวิจัยเกี่ยวกับศพ
- งานวิจัยที่ทำในศพซึ่งได้รับการบริจาคเพื่อการศึกษาและการวิจัย จะต้องได้รับอนุญาตจากผู้มีอำนาจอนุมัติ
- งานวิจัยที่ทำในศพซึ่งไม่ได้รับการบริจาคเพื่อการศึกษาและการวิจัย จะต้องได้รับความยินยอมจากทายาทหรือผู้มีสิทธิ์ในศพนั้นอนุญาต
การพิจารณาแบบเร็ว (Expedited)
สำหรับโครงการวิจัยที่มี ความเสี่ยงต่ออาสาสมัครต่ำหรือไม่มีความเสี่ยงต่ออาสาสมัคร หรือไม่มีอาสาสมัครร่วมโครงการ เช่น การศึกษาแบบ Retrospective เป็นต้น โดยเจ้าหน้าที่ของสำนักงานฯ จะรับโครงร่างการวิจัยจากผู้วิจัย พร้อมทั้งตรวจสอบความครบถ้วนของโครงการวิจัย และเอกสารที่เกี่ยวข้อง ตามเอกสาร AF-03-007/01.0 โดยเลขานุการคณะกรรมการพิจารณาจริยธรรมการวิจัยในมนุษย์ คัดเลือกโครงร่างการวิจัย ในเอกสาร AF-01-007/01.0 เพื่อพิจารณาแบบเร็ว หลังจากนั้นคณะกรรมการฯ (Expedited Reviewers) ที่ได้รับการมอบหมายจากประธาน จํานวน 3 คน จะเป็นผู้ทบทวนโครงร่างการวิจัย และ แจ้งผลการพิจารณา ภายในเวลา 2 สัปดาห์ หลังจากได้รับโครงร่างการวิจัย (หากไม่มีเหตุขัดข้องใด ๆ) โดยลักษณะของโครงการวิจัยที่เข้าเกณฑ์การพิจารณาแบบเร็ว (Expedited) มีดังนี้
- โครงร่างการวิจัยที่ใช้แบบสอบถามซึ่งไม่มีความเสี่ยงหรือมีความเสี่ยงน้อยต่ออาสาสมัครที่เข้าร่วมในโครงร่างการวิจัย
- โครงร่างการวิจัยที่เป็นการศึกษาแบบสังเกตการณ์ ที่ไม่มีความเสี่ยง หรือมีความเสี่ยงน้อย และไม่บ่งชี้ถึงตัวผู้เข้าร่วมการวิจัย
- โครงร่างการวิจัยที่เป็นการเก็บข้อมูลจากประวัติการรักษาของผู้ป่วย โดยไม่มีการเชื่อมโยงไปถึงตัวผู้เข้าร่วมการวิจัย
- การขอปรับแก้โครงร่างการวิจัยเดิมเพียงเล็กน้อยไม่ทำให้มีความเสี่ยงเพิ่มขึ้น และเป็นโครงร่างการที่ผ่านการอนุมัติแล้ว
- การขอปรับแก้ใบยินยอมของโครงร่างการวิจัยเดิมที่ผ่านการอนุมัติแล้ว
- รายงานผู้ป่วยไม่เกิน 10 ราย (Case report, Cases report, Case series)
หมายเหตุ: ในกรณีที่คณะกรรมการฯ คนใดคนหนึ่งที่ทบทวนหรือประธาน ไม่เห็นชอบ กรรมการและเลขานุการฯ จะต้องนำโครงร่างการวิจัยเข้าพิจารณาในที่ ประชุมคณะกรรมการจริยธรรมการวิจัยในคนชุดใหญ่ (Full Board)
การพิจารณาแบบปกติ (Full board)
สำหรับโครงการวิจัยที่มี ความเสี่ยงต่ออาสาสมัครปานกลางถึงสูง และต้องได้รับการลงมติในที่ประชุมของคณะกรรมการจริยธรรมฯ โดยเจ้าหน้าที่ของสำนักงานฯ จะรับโครงร่างการวิจัยจากผู้วิจัย พร้อมทั้งตรวจสอบความครบถ้วนของโครงการวิจัย และเอกสารที่เกี่ยวข้อง ตามเอกสาร AF-04-007/01.0 โดยการส่งยื่นเอกสารเพื่อขอรับพิจารณาฯ จะต้องยื่นภายในวันที่ 7 ของเดือนที่จัดประชุมคณะกรรมการเพื่อพิจารณาโครงการวิจัยที่ยื่นขอรับการพิจารณาจริยธรรมการวิจัยในมนุษย์ จะจัดขึ้นทุก ๆ วันพุธสัปดาห์ที่ 4 ของเดือน (ตัวอย่าง การประชุมคณะกรรมการเพื่อพิจารณาโครงการวิจัยที่ยื่นขอรับการพิจารณาจริยธรรมการวิจัยในมนุษย์ จัดขึ้นในวันที่ 25 มีนาคม 2563 ผู้วิจัยจะต้องส่งเอกสารภายในวันที่ 7 มีนาคม 2563)
ผู้วิจัยจะต้องเข้าร่วมประชุมเพื่อชี้แจงข้อมูล โดยผู้ที่เข้าร่วมประชุมเพื่อชี้แจงจะต้องเป็นผู้ที่มีความรู้และความเข้าใจในตัวงานวิจัย โดยเป็นได้ทั้งหัวหน้าโครงการวิจัยและผู้ร่วมวิจัย (หากผู้วิจัยมีเหตุจำเป็นที่ไม่สามารถเข้าร่วมหรือส่งตัวแทนได้ โปรดแจ้งมาทางคณะกรรมการจริยธรรมการวิจัยในมนุษย์ โรงพยาบาลเลิดสินเพื่อขอเลื่อนการพิจารณา แต่หากมีความจงใจที่จะไม่เข้าร่วมประชุม คณะกรรมการจริยธรรมการวิจัยในมนุษย์ โรงพยาบาลเลิดสินขอสงวนสิทธิ์ในการไม่พิจารณาโครงการวิจัยนั้น ๆ จนกว่าผู้วิจัยจะดำเนินการให้แล้วเสร็จ
หลังจากกำหนดเกณฑ์การพิจารณาที่เหมาะสมกับโครงการวิจัยแล้ว ผู้วิจัยจึงจะสามารถจัดเตรียมเอกสารได้อย่างถูกต้องและครบถ้วนตามแบบตรวจสอบเอกสารของแต่ละเกณฑ์การพิจารณา โดยการระบุข้อมูลลงในแบบฟอร์มนั้น ผู้วิจัยต้องระบุข้อมูลให้ครบถ้วนและถูกต้อง หากไม่เป็นไปตามที่กำหนด คณะกรรมการจริยธรรมการวิจัยในมนุษย์ขอสงวนสิทธิ์ในไม่การพิจารณาโครงการวิจัยนั้น ๆ จนกว่าผู้วิจัยจะดำเนินการให้แล้วเสร็จ